
Скорость молекулярных движений
Распределение скоростей между различными молекулами одного и того же газа дается формулой:
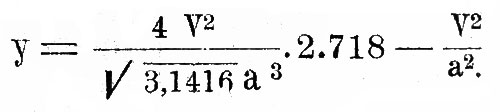
Это выражение дает вероятность у существования скорости, заключенной между V и V+dv в функции наиболее вероятной скорости а и численных постоянных. Другими словами, если мы имеем весьма большое число частиц N некоторого газа, то будет существовать
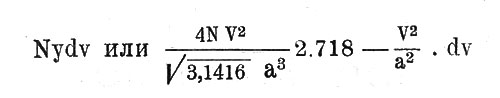
молекул, обладающих скоростями, заключенными между V и V+dv.
Численное значение этой формулы можно представить кривой.
Так как а - наиболее вероятная скорость, то этой абсциссе и соответствует высшая точка кривой. Соответствующую ординату получим, очевидно, положив в формуле V=a. Будем иметь:
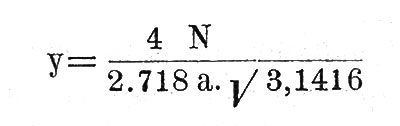
С обеих сторон от наиболее вероятной скорости а - вероятность других скоростей быстро падает с удалением от абсцисы а. При v=o, у=о; при v=∞ - тоже. Таким образом, кривая с увеличением v ассимптотически приближается к оси абсцисс.
Численные значения вероятностей скоростей, отличающихся от наиболее вероятной скорости, даны в нижеследующей таблице:

Эта таблица показывает чрезвычайно быстрое падение вероятностей скоростей с увеличением этих последних по сравнению со скоростью наиболее вероятной. Так, вероятность скорости, превосходящей наиболее вероятную скорость вдвое - составляет 0,2, а вероятность тройной скорости по отношению к наиболее вероятной падает уже до 3.10-3.
Далее падение вероятностей совершается все стремительнее.
|
ПОИСК:
|
© ADEVA.RU, 2001-2019
При использовании материалов сайта активная ссылка обязательна:
http://adeva.ru/ 'Энциклопедия небесных тел'
При использовании материалов сайта активная ссылка обязательна:
http://adeva.ru/ 'Энциклопедия небесных тел'